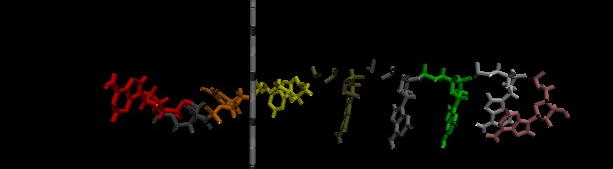در نوشته های قبلی در مورد خمش پروتئین صحبت کردیم. که چگونه یک پروتئین شکل فضایی خود را پیدا میکند. در فیزیک مفهوم مهمی داریم به نام انرژی. سیستمهای مکانیکی همواره در جهت کاهش انرژی حرکت می کنند. مثلا اگر توپی را رها کنیم به پایین سقوط می کند. زیرا حرکت در جهت میدان گرانشی، انرژی پتانسیل توپ را کاهش میدهد. یا مثلا یک بار مثب توسط یک بار مشابه دفع می شود. زیرا با افزایش فاصله دو بار انرژی پتانسیل ذخیره شده بین آنها کاهش می یابد.
اما هنگامی که تعداد ذرات زیاد میشود، پارامتر دیگری اهمیت پیدا می کند. تعداد حالت های ممکن یک سیستم با انرژی خاص هم در احتمال حضور سیستم در آن انرژی و یا یک حالت خاص مؤثر است. کمیت فیزیکی مرتبط با تعداد حالات آنتروپی است. آنتروپی، چنان که در نوشته های قبلی هم اشاره شد، متناسب با لگاریتم تعداد حالت های ممکن سیستم است. اما یک پارامتر مهم دیگر هم در اینجا وجود دارد که میزان در دسترس بودن انرژی گرمایی را نشان می دهد. این پارامتر همان دمای سیستم است. بله، دما البته دمای مطلق! (این دما همان دما در واحد سلسیوس است که به عددی در حدود 273 اضافه شده است.) صفر مطلق، دمایی است که انرژی جنبشی کلا از بین می رود.
اما بریم سراغ اصل مطلب! یعنی وقتی تعداد ذرات زیاد شود، سیستم به کدام سمت حرکت می کند؟
فیزیکدانان برای پاسخ به این سوال، کمیتی تعریف می کنند به نام انرژی آزاد:
F = E – TS
که E انرژی و S آنتروپی سیستم را نشان می دهند. برای بررسی یک سیستم فیزیکی با تعداد زیادی ذره باید به جای انرژی از انرژی آزاد استفاده کنیم. چنان که مشاهده می کنید، این انرژی به دما و آنتروپی وابسته است. در واقع هرچه دمای سیستم بیشتر می شود، اهمیت آنتروپی یا تعداد حالات افزایش می یابد.
در نوشته های بعدی بیشتر در این باره صحبت خواهیم کرد.
بهتر از قبل باشید، عبدالوهاب.